Introducción
Las reacciones químicas siguen una serie de normas que quedaron establecidas en leyes (por que son indudablemente ciertas) por los científicos que las estudiaron. La teoría atómica de Dalton es capaz de justificar esas leyes. A continuación veremos cada una de esas leyes.
Ley de la conservación de la masa
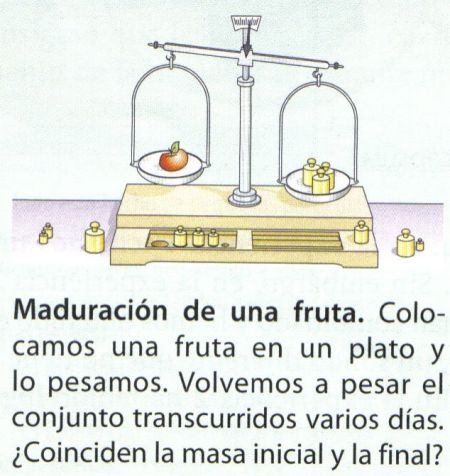 Imagina que la semana pasada pesamos en el laboratorio una manzana y una manzana dentro de un bote. Una de ellas ha pasado la semana al aire libre, mientras que la otra ha pasado la semana en un bote de cristal cerrado. Volvemos a pesar la manzana al aire libre. Ésta pesa menos que antes. Al pesar el bote con la manzana dentro, vemos que pesa igual. La manzana al aire libre se ha puesto más madura, es decir, ha sufrido una reacción de oxidación, por eso ha perdido parte de su masa y ha cambiado su color. La manzana está hecha casi toda de carbono. La reacción que ha ocurrido es:
Imagina que la semana pasada pesamos en el laboratorio una manzana y una manzana dentro de un bote. Una de ellas ha pasado la semana al aire libre, mientras que la otra ha pasado la semana en un bote de cristal cerrado. Volvemos a pesar la manzana al aire libre. Ésta pesa menos que antes. Al pesar el bote con la manzana dentro, vemos que pesa igual. La manzana al aire libre se ha puesto más madura, es decir, ha sufrido una reacción de oxidación, por eso ha perdido parte de su masa y ha cambiado su color. La manzana está hecha casi toda de carbono. La reacción que ha ocurrido es:
C+O2==>CO2
Como el CO2 es un gas, se va a la atmósfera y la manzana pierde masa por que le han quitado átomos de C.
La manzana que estaba dentro del bote también ha madurado. Pero al estar cerrado herméticamente el bote, el CO2 no ha podido escapar a la atmósfera. Si se ha ido un átomo de carbono de la manzana, ahora está en el aire encerrado dentro del bote: el peso del conjunto bote+manzana es el mismo.
La ley de conservación de masa fue escrita por Lavoisier, considerado por muchos como el padre de la química moderna, en 1789 (El año en que sucedió la revolución francesa). Dice así:
 –La masa de un sistema permanece constante, cualquiera que sea la transformación que ocurra dentro de él.
–La masa de un sistema permanece constante, cualquiera que sea la transformación que ocurra dentro de él.
-En cualquier transformación química que tenga lugar en un sistema cerrado, la masa total de las sustancias allí existentes se conserva.
En pocas palabras, la masa en una reacción química permanece constante.
¿Cómo justifica la teoría atómica de Dalton esta ley?
 Si en una reacción química lo que ocurre es una reorganización de los átomos, y los átomos no cambian sus propiedades ni se cambian a otro tipo de átomo ni se pueden romper o aparecer de la nada, como hay el mismo número de átomos y su masa no varía, la masa de las sustancias iniciales y la masa de las sustancias finales tiene que ser la misma.
Si en una reacción química lo que ocurre es una reorganización de los átomos, y los átomos no cambian sus propiedades ni se cambian a otro tipo de átomo ni se pueden romper o aparecer de la nada, como hay el mismo número de átomos y su masa no varía, la masa de las sustancias iniciales y la masa de las sustancias finales tiene que ser la misma.
ACTIVIDADES
1. Al calentar 46,4 gramos de óxido de plata en un recipiente abierto, queda un residuo sólido de 43,2 gramos de masa de plata pura. ¿Qué ha sucedido?
a) No se cumple la ley de Lavoisier
b) Se ha cometido un error al medir las masas antes y después de la reacción
c) Se ha formado 3,2 gramos (la resta de la masa de la sustancia inicial menos la masa de la sustancia final) de una sustancia gaseosa que ha escapado a la atmósfera. Correcto. La ley de conservación de masa siempre se cumple, la reacción que ha ocurrido al calentar el óxido de plata es: AgO2 ==> Ag + O2
2. Pesamos una vela antes y después de encenderla y observamos que ha perdido masa.
a) ¿Acaso no se cumple la ley de conservación de la masa? Sí, siempre se cumple.
b) ¿Cómo explicarías este hecho? Lo que sucede es que la vela, al quemarse, pierde peso por que una de las sustancias que se forma en la combustión es un gas, el CO2, que se va a la atmósfera.
3. Si se calienta un alambre de cobre, se forma óxido de cobre y la masa del alambre aumenta.
a) ¿Se cumple la ley de conservación de masa? Sí, siempre se cumple.
b)¿Cómo explicarías este hecho? El cobre ha ganado peso por que ha cogido oxígeno de la atmósfera. La atmósfera ve disminuido su peso, pero hay tanto aire que esa pérdida es inapreciable.
septiembre 12, 2018 a las 8:26 am
Tienes twitter?